FAQ Antibiotikamengen
Rechtliche Fragen/Allgemeines
1. Auf welcher Rechtsgrundlage beruht die Verpflichtung zur Sammlung der Verbrauchsdaten von antimikrobiellen Arzneimitteln?
Bereits seit dem Jahr 2014 werden in Österreich basierend auf der Veterinär-Antibiotika-Mengenströme-Verordnung (Vet-AB-MengenströmeVO), BGBl. II Nr. 83/2014, auf nationaler Ebene Verkaufsmengen von Veterinär-Antibiotika durch Großhändler und Zulassungsinhaber sowie die Abgabemengen der Tierärztinnen/Tierärzte aus ihren tierärztlichen Hausapotheken (TÄHAPOs) an lebensmittelliefernde Tiere erfasst und ausgewertet.
Seit 28.01.2022 ist in der Europäischen Union das neue Tierarzneimittel-Recht, die Verordnung VO (EU) 2019/6 in Kombination mit den auf Grundlage des Artikel 57 veröffentlichten Durchführungsrechtsakten VO (EU) 2021/578 und VO (EU) 2021/1248 in Kraft und entsprechend anzuwenden. Es sollen Risikofaktoren für die Tiergesundheit und auch die öffentliche Gesundheit ermittelt werden, um gezielte Maßnahmen zur Bekämpfung antimikrobieller Resistenzen entwickeln zu können. Als Grundlage dafür wird die Ermittlung relevanter Trends beim Verkaufsvolumen und bei der Anwendung antimikrobieller Mittel bei Tieren auf nationaler und Unionsebene gesehen. Zusammen mit den Entwicklungen beim Verbrauch antimikrobieller Mittel beim Mensch und mit einschlägigen Daten über antimikrobiell resistente Organismen, die bei Tieren und Menschen, in Lebensmitteln sowie in der Umwelt festgestellt werden, soll eine integrierte Analyse ermöglicht werden. Aus dieser sollen entsprechende Maßnahmen im Sinne des europäischen Aktionsplans zur Bekämpfung antimikrobieller Resistenzen gemäß dem „One Health/Eine Gesundheit“-Konzept abgeleitet werden.
Die Mitgliedstaaten haben geeignete nationale Datenerhebungssysteme zu entwickeln bzw. weiterzuführen, um eine vollständige Erfassung qualitativ hochwertiger Daten über den Einsatz bei der jeweils betroffenen Tierart zu erreichen.
Die EU-weit harmonisierte Datenerfassung/Meldeverpflichtung von Antibiotika-Mengenströmen im Veterinärbereich wird also auf Basis der bereits bestehenden Veterinär-Antibiotika-Mengenströme-Verordnung schrittweise ausgeweitet (EU: VO 2019/6, VO 2021/578). Ab 2024 ist die gesamte Anwendung („use“) [= die Abgabe, zusätzlich die direkte Anwendung und die Verschreibung durch den/die Tierärzt:in] von Antibiotika an lebensmittelliefernde (LM)-Tiere zu melden. Ab 2027 ist die Anwendung bei Pferden und ab 2030 auch die Anwendung bei den nicht LM-liefernden Tieren Hund, Katze und Pelztiere (Nerze und Füchse)) zu melden.
2. Wozu eine EU-weite Erfassung der Verbrauchsdaten für Arzneimittel mit antimikrobiellen Wirkstoffen?
Unter den antimikrobiellen Arzneimitteln zählen Antibiotika zu den weltweit am häufigsten verschriebenen Arzneimitteln. Mit 13 Prozent Marktanteil bilden sie den größten Einzelbereich nach der gesamten Erfassung unseres Arzneimittelverbrauchs.
Die drohende Gefahr, dass Antibiotika ihre Wirkung verlieren, ist weltweit zu einer großen Herausforderung im Gesundheitsbereich geworden. Antibiotikaresistenzen bzw. ihre Resistenzdeterminanten beachten keine Grenzen, daher genügen nicht lediglich landes- und europaweite Kooperationen – es müssen globale Strategien gegen Resistenzbildung und -verbreitung entwickelt und umgesetzt werden.
Strategien zur Reduktion des Antibiotikaeinsatzes (in allen Bereichen) sind von übergeordneter Wichtigkeit für das Erhalten der Wirksamkeit von Antibiotika zum Wohle von Mensch, Tier und Umwelt. Zudem gilt es in einem ganzheitlichen Ansatz („One Health“ - Strategie) möglichst geringe Konzentrationen von antibiotisch wirksamen Substanzen, resistenten Mikroorganismen oder Resistenzgenen in die Umwelt abzugeben.
3. Gibt es eine konsolidierte Liste aller in der EU zugelassenen Tierarzneimittel?
Auf folgenden Homepages finden Sie alle in der EU zugelassenen Tierarzneimittel.
4. Was versteht man unter antimikrobiellen Arzneimitteln bzw. Antimikrobiotika? Sind Antimikrobiotika mit Antiinfektiva gleichzusetzen?
Die neue EU-Tierarzneimittel-Verordung definiert „antimikrobielle Wirkstoffe“, d.h. Antimikrobiotika – die einen Großteil der Antiinfektiva ausmachen - als jeden zur Therapie oder Abwehr von Infektionen oder Infektionskrankheiten eingesetzten Stoff mit unmittelbarer und gezielter Wirkung auf Mikroorganismen wie Bakterien, Viren, Pilze und Protozoen. Damit sind neben Antibiotika nun auch Virostatika, Antimykotika und Antiprotozoika von der Datenerfassung betroffen. Ausgenommen ist nur eine Gruppe von Antiinfektiva, die Antihelmintika, die nicht gegen mikroskopisch kleine Erreger gerichtet sind, aber auch zu den Antiinfektiva zählen.
Im Sinne der Veterinär-Antibiotika-Mengenströme-Verordnung (zuletzt geändert durch BGBl. II Nr. 127/2022) sind Antibiotika antimikrobiell wirksame Substanzen, deren Wirkung sich gegen Bakterien und bestimmte Einzeller richtet. Sie werden in Form von zugelassenen Arzneispezialitäten als Tierarzneimittel in Verkehr gebracht und sind im ATCvet (Anatomical Therapeutic Chemical) System der WHO zur Klassifizierung von Wirkstoffen in Tierarzneimitteln unter den Codes QA (Verdauungstrakt und Stoffwechsel), QD (Dermatologika), QG (Urogenitaltrakt), QJ (Antiinfektiva zur systemischen Anwendung) und QP51AG (Antiprotozoika mit antibakterieller Wirkung), sowie unter QR (Respirationstrakt) und QS (Sinnesorgane) zu finden.
Von der Datenerfassung betroffene Wirkstoffe von Virostatika, Antimykotika und Antiprotozoika finden sich unter den Codes QD, QJ, QP51, QR und QS (Details dazu siehe FAQs weiter unten).
5. Was ist der Tierarzneimitteldatensatz?
Der in § 3 der Veterinär-Antibiotika-Mengenströme-Verordnung (Vet-AB-MengenströmeVO) beschriebene Tierarzneimittel/Arzneimittel-Datensatz enthält Informationen zu allen Tierarzneimitteln mit antimikrobiellen Wirkstoffen, aber auch Informationen zu allen anderen in Österreich zugelassenen Tierarzneimitteln, die den Tierärzt:innen für ihre Tätigkeit zur Verfügung stehen. In naher Zukunft wird der Datensatz um bestimmte antimikrobielle Humanarzneimittel ergänzt werden, deren ATC-Codes in der VO (EU) 2021/578 angeführt sind, da Tierärzt:innen in bestimmten Fällen im Rahmen eines Therapienotstandes berechtigt sind, auch Humanarzneimittel einzusetzen. Der Datensatz wird von der AGES auf dem neuesten Stand gehalten bzw. laufend ergänzt und aktualisiert und kann unter onlineService Veterinär Antibiotika Mengenstromanalyse heruntergeladen werden.
Detaillierte, dem aktuellen Stand entsprechende Angaben über die Anwendung des jeweiligen Tierarzneimittels/Arzneimittels finden Sie in der Fach- und Gebrauchsinformation - der Link dazu ist im Datensatz des jeweiligen Tierarzneimittels/Arzneimittels enthalten.
6. Welche Daten enthält der Tierarzneimittel/Arzneimittel-Datensatz („Stammdatendownload“)?
Änderung auf Basis der Novelle der nationalen Veterinär-Antibiotika-MengenströmeVO zu erwarten!
Der Arzneimittel-Datensatz für Nutztier-Antibiotika enthält den großen Stammdatensatz (siehe Anhang 1 der VO BGBl II 83/2014, Punkt 1.1.1), der unter anderem auch Angaben zu Dosierung oder Dauer der Anwendung inkludiert. Der Arzneimittel-Datensatz für Antibiotika, die für Heimtiere oder Pferde zugelassen sind, besteht prinzipiell auch aus den Datenfeldern des großen Stammdatensatzes, jedoch sind hier jene Felder, die kein Pflichtfeld gem. Vet-AB-MengenströmeVO darstellen nicht befüllt. Daten, die zwecks Erfassung der Verbrauchsdaten antimikrobieller Arzneimittel für LM-liefernde Tiere gem. o.g. Verordnung erforderlich sind, wie z.B. die Dosierung, werden hier nicht angeführt. Diese Informationen können der jeweiligen Fach- und Gebrauchsinformation entnommen werden (siehe Link im XML-Download).
Für alle sonstigen zugelassenen Tierarzneimittel (z.B. Herz-Kreislaufmittel, Narkotika, Analgetika u.a.) enthält der Arzneimittel-Datensatz den sogenannten kleinen Datensatz (siehe Anhang 1 der VO BGBl II 83/2014, Punkt 1.1.2).
Für alle Humanarzneimittel mit einem in der VO (EU) 2021/578 genannten ATC-Code wird im Stammdatendownload ebenfalls ein Datensatz mit den für die Meldung erforderlichen Daten ausgegeben.
7. Welche Meldeverpflichtungen bestehen nach der Veterinär-Antibiotika-MengenströmeVO?
Änderung auf Basis der Novelle der nationalen Veterinär-Antibiotika-MengenströmeVO zu erwarten!
Meldeverpflichtet sind:
1. Unternehmen die Tierarzneimittel mit antimikrobiellen Wirkstoffen vertreiben, sind zu einer jährlichen Vertriebsmeldung verpflichtet, wobei nicht nur der Vertrieb an tierärztliche Hausapotheken (TÄ-HAPO), sondern an alle im Folgenden genannten Stellen zu melden ist:
tierärztliche Hausapotheken
- öffentliche Apotheken
- Anstaltsapotheke der Veterinärmedizinischen Universität Wien
- Apotheke(n) des Österreichischen Bundesheeres
- sonstige bezugsberechtigte Stellen, für die das Bundesministerium für Gesundheit eine ID-Nummer vergibt
2. Hausapotheken-führende Tierärzt:innen, die im Erfassungszeitraum 2022 Tierarzneimittel/Arzneimittel mit antimikrobiellen Wirkstoffen (dzt. nur Antibiotika gem. § 2(1) VetABM-VO) aus ihrer TÄ-HAPO an Tierhalter:innen zur Behandlung von lebensmittelliefernden Tieren gem. § 7 Vet-AB-MengenströmeVO abgegeben haben, sind noch einmal im Jahr 2023 nur zu einer sog. Abgabemeldung [Jahresmeldung = Abgabe von AB an den/die Tierhalter:in] verpflichtet.
NEU ab dem Meldejahr 2023: Hausapotheken-führende Tierärzt:innen, die im Erfassungszeitraum ab 2023 Tierarzneimittel/Arzneimittel mit antimikrobiellen Wirkstoffen (= alle Klassen antimikrobieller Arzneimittel) aus ihrer TÄ-HAPO abgeben, direkt am Tier anwenden oder per Verschreibung verordnen, sind ab 2024 zu einer Abgabemeldung [Jahresmeldung = Abgabe von AB an den/die Tierhalter:in wie bisher] und neu zu einer Anwendungsmeldung [Meldung von Verschreibungen und der Anwendung durch den/die jeweilige Tierärzt:in selbst] verpflichtet.
3. NEU seit 2022: Hausapotheken-führende Tierärzt:innen, die im Erfassungszeitraum keine antimikrobiellen Arzneimittel aus ihrer TÄ-HAPO an den/die Tierhalter:in von lebensmittelliefernden Tiere gem. § 7 Vet-AB-MengenströmeVO abgeben haben, sind seit 2022 zu einer sog. Abgabe-Leermeldung verpflichtet.
4. Zusätzlich weiterhin unverändert möglich ist die freiwillige Detailmeldung der Anwendung gem. §8 Veterinär-Antibiotika-MengenströmeVO.
8. Warum werden für freiwillige Detailmeldungen der Anwendung Vorgaben in einer Verordnung gemacht?
Änderung auf Basis der Novelle der nationalen Veterinär-Antibiotika-MengenströmeVO zu erwarten!
Die freiwillige Detailmeldung (der Anwendung) von Daten über die Anwendung durch die/den Tierärzt:in bzw. dem/der Tierhalter:in dient der besseren Nachvollziehbarkeit, Zuordenbarkeit und Vergleich¬barkeit der am Einzeltier bzw. der an einer Gruppe von Tieren angewendeten Antibiotika.
HAPO-TÄ können diese freiwillige Detailmeldung der Meldungen entweder selbständig durchführen oder über einen Bündler melden.
Meldungen über die Anwendung von Arzneimitteln mit antimikrobiellen Wirkstoffen, die sog. freiwilligen Detailmeldungen, werden auf freiwilliger Basis abgegeben. Für die Erfassung dieser Meldungen ist es notwendig, dass dabei ein einheitliches Datenformat benutzt wird. Daher ist es erforderlich, dass dieses Datenformat in der Verordnung vorgegeben wird.
9. Was bedeutet Berichtsjahr?
Das Berichtsjahr (= das dem Meldejahr folgende Jahr) entspricht dem Jahr, in welchem die Daten elektronisch zu übermitteln sind. Die im Meldejahr erfassten Daten sind im Folgejahr elektronisch an die durchführende Stelle abzugeben. Beispiel: Im Berichtsjahr 2023 werden die Daten, die im Meldejahr 2022 erfasst wurden an das AGES-e-Service übermittelt.
10. Was bedeutet Meldejahr?
Das Meldejahr entspricht dem Erfassungszeitraum für den Sie Ihre Meldung abgeben. Beispiel: Sie melden im Berichtsjahr 2022 die Daten aus dem Meldejahr 2021. Wenn Sie Ihre Jahresmeldung oder Leermeldung abgeben, dann tun Sie dies im Regelfall für das gesamte vorangegangene Jahr. Wenn Sie allerdings planen, Ihre TÄHAPO im aktuellen Jahr aufzugeben (Pensionierung, Umzug etc.), dann können Sie bereits auch für das angefangene Jahr Ihre Meldung abgeben, dann ist als Meldejahr 2022 zu wählen bzw. das entsprechende Jahr, in dem Sie die Meldung abgeben wollen.
11. Was ist die TÄ-HAPO-Nummer?
Jede tierärztliche Hausapotheke (TÄ-HAPO) bekommt eine individuelle, unverwechselbare Nummer. Diese besteht aus den Buchstaben „HA“, der fünfstelligen Standortnummer (Berufssitz des/der Tierärzt:in mit Bundesländerkennzahl) sowie der Tierarztnummer (ebenfalls fünfstellig).
z.B.: HA1234567891
12. Als Unternehmer:in vertreibe ich Tierarzneimittel mit antimikrobiellen Wirkstoffen an tierärztliche Hausapotheken und/oder andere Apotheken. Welche Pflichten treffen mich?
Änderung auf Basis der Novelle der nationalen Veterinär-Antibiotika-MengenströmeVO zu erwarten!
Folgende Einrichtungen sind in die verpflichtende Meldung von Unternehmen einzubeziehen:
- tierärztliche Hausapotheken
- öffentliche Apotheken
- Anstaltsapotheke der Veterinärmedizinischen Universität Wien
- Apotheke(n) des Österreichischen Bundesheeres
- sonstige bezugsberechtigte Stellen, für die das Bundesministerium für Gesundheit eine ID-Nummer vergibt
Unternehmen, die Tierarzneimittel mit antimikrobiellen Wirkstoffen an tierärztliche Hausapotheken (TÄ-HAPO) und/oder andere Apotheken vertreiben, haben über diese Verkäufe Aufzeichnungen zu führen, mit deren Hilfe eine Jahresmeldung (= jährliche Vertriebsmeldung) nach § 6 Vet-AB-MengenströmeVO abgegeben werden muss.
13. Als Unternehmer:in möchte ich die Jahresmeldung über den Vertrieb abgeben. Welche Fristen habe ich dabei zu beachten?
Die Jahresmeldung (= jährliche Vertriebsmeldung) nach der Vet-AB-MengenströmeVO hat bis zum 31. März des Folgejahres für das betreffende Meldejahr zu erfolgen.
14. Als Unternehmer:in möchte ich wissen, welche Tierarzneimittel/Arzneimittel von der Mengenstromerfassung betroffen sind.
Änderung auf Basis der Novelle der nationalen Veterinär-Antibiotika-MengenströmeVO zu erwarten!
Die noch bis Ende 2022 von der Mengenstromerfassung betroffenen ATCvet-Codes von Tierarzneimitteln mit antimikrobiellen Wirkstoffen (= Antibiotika) sind in den „Amtlichen Veterinärnachrichten“ veröffentlicht.
NEU: Die zukünftig (ab 2023) für die Vertriebsmeldung benötigten ATCvet-Codes von Tierarzneimitteln sind in der Verordnung (EU) 2021/578 der Kommission veröffentlicht. Dabei wird zwischen ATCvet-Codes von antimikrobiellen Tierarzneimitteln, die verpflichtend zu melden sind und solchen mit einem ATCvet-Code, die auf freiwilliger Basis gemeldet werden können, unterschieden.
Die Vertriebsmeldung umfasst alle Tierarzneimittel, die antimikrobielle Wirkstoffe enthalten und die für Nutztiere und/oder Heimtiere in Österreich oder in der gesamten EU zugelassen sind; auch jene Tierarzneimittel, die ausschließlich für Heimtiere zugelassen sind (siehe auch FAQ).
15. Ich bin Tierärzt:in und will eine tierärztliche Hausapotheke (TÄ-HAPO) anmelden.
Sie müssen – wie auch schon bisher - die Eröffnung einer TÄ-HAPO 14 Tage vor der geplanten Eröffnung bei der für Ihren Berufssitz örtlich zuständigen Bezirksverwaltungsbehörde anzeigen.
16. Ich bin Tierärzt:in und möchte in die Liste der hausapotheken-führenden Tierärzt:innen eingetragen werden. Muss ich aktiv etwas tun?
Abgesehen von der Anzeige über die geplante Eröffnung der tierärztlichen Hausapotheke müssen Sie keine weiteren Schritte unternehmen: Ihre Anzeige wird von der Bezirksverwaltungsbehörde an die Österreichische Tierärztekammer (ÖTK) weitergeleitet, diese nimmt die Eintragung vor.
17. Ich bin Tierärzt:in und möchte wissen, wie ich an meine TÄ-HAPO-Identifikationsnummer komme.
Die TÄ-HAPO-Identifikationsnummer wird von der ÖTK vergeben. Sollten Sie Ihre TÄ-HAPO-ID noch nicht bekommen haben, kontaktieren Sie bitte die ÖTK.
18. Ich bin Tierärzt:in und führe eine TÄHAPO. Welche generellen Aufzeichnungspflichten treffen mich?
In der TÄHAPO müssen grundsätzlich alle Warenein- und -ausgänge erfasst werden. Die Aufzeichnungen sind elektronisch zu führen.
19. Ich bin Tierärzt:in und führe eine TÄ-HAPO, meine Aufzeichnungen führe ich aber händisch. Was ändert sich für mich?
Durch die Änderung der Apothekenbetriebsordnung wurde die Verpflichtung eingeführt, die Aufzeichnungen elektronisch zu führen. Dies war mit einer längeren Übergangsfrist gekoppelt: Sie hatten bis 31.12.2018 Zeit, die Aufzeichnungen Ihrer TÄ-HAPO auf elektronische Basis umzustellen.
20. Ist eine Verschreibung als Abgabe zu verstehen und von der/dem Tierärztin/Tierarzt zu melden?
Ja, eine Verschreibung ist als Abgabe zur Anwendung (mittels Rezept über eine öffentliche Apotheke oder sonstige berechtigte Stellen) zu verstehen und dementsprechend in der Abgabe-Meldung zu erfassen.
21. Ich bin Tierärzt:in und gebe Arzneimittel mit antimikrobiellen Wirkstoffen aus meiner tierärztlichen Hausapotheke an Tierhalter:innen ab. Welche Pflichten treffen mich?
Tierärzt:innen die eine TÄHAPO führen, haben - neben der Verpflichtung aus der Apothekenbetriebsordnung 2005 - Aufzeichnungen über Warenein- und -ausgänge zu führen; derzeit ist eine Jahresmeldung über abgegebene Arzneimittel mit antimikrobiellen Wirkstoffen (bis 2023 nur Abgabemeldung), gesondert nach Betrieben bzw. Tierhalter:innen, an die solche Arzneimittel abgegeben wurden, zu erstatten (§ 7 Vet-AB-MengenströmeVO). Die jährliche Meldung hat bis zum 31. März des Folgejahres zu erfolgen.
Diese Form der Abgabemeldung ist nur noch im Jahr 2023 durchzuführen (für den Erfassungszeitraum/das Meldejahr 2022).
Die Meldeverpflichtungen ab dem Meldejahr 2023 ist in der folgenden FAQ „Was ändert sich für Tierärzt:innen bei der Jahresmeldung (= Meldung der Abgabe und Meldung der Anwendung) ab 2024?“ beschrieben.
22. Was ändert sich für Tierärzt:innen bei der Jahresmeldung (= Abgabemeldung und Anwendungsmeldung) ab 2024?
Die zukünftige Jahresmeldung (Abgabemeldung und Anwendungsmeldung) entspricht der bisherigen bekannten Form der Meldung, wenn man als TÄHAPO-führende Tierärzt:in Tierarzneimittel mit antimikrobiellen Wirkstoffen an lebensmittelliefernde Tiere gem. § 7 Absatz 2 Vet-AB-MengenströmeVO abgegeben hat.
Die Erfassung der Abgabe von antimikrobiellen Mitteln an den/die Tierhalter:in oder Landwirt:in durch den/die Tierärzt:in wird zukünftig - beginnend mit dem Erfassungszeitraum 2023 - ab 1. Jänner 2023 um die Erfassung sämtlicher Verschreibungen („Rezepte“) von Arzneimitteln mit antimikrobiellen Wirkstoffen erweitert. Und zusätzlich sind ab 1. Jänner 2023 auch die Daten aus der Anwendung im eigentlichen Sinn, also der direkten Anwendung am Tier, zu sammeln und beginnend mit 2024 erstmals zu melden.
Die Abgabe und die Anwendung umfasst dabei in Österreich bzw. in der gesamten EU zugelassene Tierarzneimittel mit antimikrobiellen Wirkstoffen, aber auch antimikrobielle Humanarzneimittel sowie antimikrobielle Arzneimittel, die im Rahmen eines Therapienotstandes „umgewidmet“ oder nach dem Arzneiwareneinfuhrgesetz nach Österreich „importiert“ (= verbracht) und von Tierärtz:innen an Tieren angewendet oder an deren Besitzer:in/Halter:in abgegeben werden.
23. Ich bin Tierärzt:in und möchte wissen, welche Arzneimittel von der Mengenstromerfassung betroffen sind.
Änderung auf Basis der Novelle der nationalen Veterinär-Antibiotika-MengenströmeVO zu erwarten!
Die noch bis Ende 2022 von der Mengenstromerfassung betroffenen ATCvet-Codes von Tierarzneimitteln sind in den „Amtlichen Veterinärnachrichten“ veröffentlicht (siehe auch FAQ weiter unten).
Die Abgabemeldung umfasst noch bis Ende 2022 nur antimikrobielle Tierarzneimittel, die für die Behandlung von Nutztieren/lebensmittelliefernden Tieren gemäß § 7 Absatz 2 Vet-AB-MengenströmeVO an den/die Tierbesitzer:in abgegeben werden. Die letzte ausschließliche Abgabemeldung ist für den Erfassungszeitraum 2022 bis zum 31. März 2023 zu tätigen.
NEU: Die zukünftig - ab dem Erfassungszeitraum/Meldejahr 2023 - von der Mengenstromerfassung betroffenen ATCvet-Codes von Tierarzneimitteln sowie auch die ATC-Codes bestimmter Humanarzneimitteln sind in der Verordnung (EU) 2021/578 der Kommission veröffentlicht. Dabei wird zwischen ATCvet-Codes von antimikrobiellen Tierarzneimitteln bzw. ATC-Codes von antimikrobiellen Humanarzneimitteln, die verpflichtend zu melden sind und solchen mit einem ATCvet-Code bzw. ATC-Code, die auf freiwilliger Basis gemeldet werden können, unterschieden.
Die neue Abgabemeldung und Anwendungsmeldung beinhaltet ab 2024 antimikrobielle Tierarzneimittel und auch antimikrobielle Humanarzneimittel, die für die Behandlung von Nutztieren/lebensmittelliefernden Tieren gemäß § 7 Absatz 2 Vet-AB-MengenströmeVO an den/die Tierbesitzer:in abgegeben, diesem per Rezept für seine Tiere verordnet werden sowie auch direkt vom/ von der Tierärzt:in an den Tieren angewendet werden (siehe auch FAQ oben).
24. Ich bin Tierärzt:in und behandle in meiner Praxis ausschließlich Kleintiere. Welche Pflichten treffen mich dann?
Die Abgabemeldung, die Anwendungsmeldung und die freiwillige Detailmeldung (der Anwendung) betrifft vorläufig nur Tierärzt:innen, die landwirtschaftliche Nutztiere gemäß § 7 Absatz 2 Vet-AB-MengenströmeVO behandeln.
NEU: Sofern Sie ausschließlich Kleintiere in Ihrer Praxis behandeln, sind Sie jedoch seit 2022 erstmals zu einer elektronischen Abgabe-Leermeldung verpflichtet. Diese ist nach erfolgter Registrierung bei AGES eServices und nach Erhalt der Zugangsdaten selbständig am Portal durchzuführen. Die Frist für die Meldung ist jeweils der 31. März des darauffolgenden Jahres.
NEU: Wenn Sie als Kleintierpraktiker:in Hunde und Katzen mit antimikrobiell wirksamen Arzneimitteln behandeln, solche Arzneimittel dem/der Tierhalter:in per Rezept für sein(e)/ihr(e) Tier(e) verschreiben bzw. antimikrobiell wirksame Arzneimittel aus Ihrer TÄ-HAPO an den/die Tierbesitzer:in abgeben, so sind Sie verpflichtet, diese Daten ab 1. Jänner 2029 zu sammeln und erstmals im Jahr 2030 bis zum 31. März eine entsprechende Abgabemeldung und Anwendungsmeldung zu machen.
25. Ich bin Tierärzt:in und behandle auch bzw. nur Pferde. Muss ich Arzneimittel mit antimikrobiellen Wirkstoffen, die ich bei Pferden einsetze bei der Mengenstromerfassung angeben?
Derzeit, d.h. noch bis 2027, ist gemäß der zugrundeliegenden Verordnung die Anwendung von Arzneimitteln mit antimikrobiellen Wirkstoffen bei Pferden (inkl. Ponys) von der Meldepflicht ausgenommen.
NEU: Wenn Sie in Ihrer Praxis Pferde (inkl. Ponys) behandeln, unabhängig davon ob diese für die Schlachtung vorgesehen sind oder gemäß Equidenpass („Pferde-Pass“) davon ausgenommen sind, so sind Sie verpflichtet ab 1. Jänner 2026 alle Abgabe- und Anwendungsdaten (Abgabe, selbständige Anwendung oder Verschreibung) von Arzneimitteln mit antimikrobiellen Wirkstoffen bei Pferden zu sammeln und im darauffolgenden Jahr, also 2027 erstmals und danach jährlich zu melden.
26. Ich bin Tierärzt:in und behandle auch bzw. nur Fische in Aquakulturen. Muss ich Arzneimittel mit antimikrobiellen Wirkstoffen, die ich bei Fischen einsetze bei der Mengenstromerfassung angeben?
Ja, denn die Abgabemeldung, die das letzte Mal in der herkömmlichen Form im Jahr 2023 für den Erfassungszeitraum 2022 abzugeben ist, umfasst antimikrobielle Tierarzneimittel, die für die Behandlung von Nutztieren/lebensmittelliefernden Tieren gemäß § 7 Absatz 2 Vet-AB-MengenströmeVO inkl. Tiere der Aquakultur an den/die Tierbesitzer:in abgegeben werden. Die Meldung hat zumindest für folgende Fischarten aus Aquakulturen zu erfolgen:
- Regenbogenforelle (Oncorhynchus mykiss),
- atlantischer Lachs (Salmo salar) und
- Karpfen (Cyprinus carpio).
NEU: ab 2024 beinhaltet auch hier die neue Meldung der Abgabe und Meldung der Anwendung antimikrobielle Tierarzneimittel sowie antimikrobielle Humanarzneimittel, die für die Behandlung der oben genannten Fischarten an den/die Tierbesitzer:in abgegeben, diesem per Rezept für seine Tiere verordnet werden sowie auch direkt vom/von der Tierärzt:in an den Tieren angewendet werden.
27. Ich bin Tierärzt:in und wende bei der Behandlung von Tieren auch selbst Arzneimittel mit antimikrobiellen Wirkstoffen an. Muss ich dies bei der Pflichtmeldung berücksichtigen?
Änderung auf Basis der Novelle der nationalen Veterinär-Antibiotika-MengenströmeVO zu erwarten!
Von Tierärzt:innen selbst angewendete Arzneimittel mit antimikrobiellen Wirkstoffen fallen ab 2023 für die Anwendung an Nutztieren/lebensmittelliefernden Tieren gemäß § 7 Absatz 2 Vet-AB-MengenströmeVO, ab 2026 zusätzlich für die Anwendung bei Pferden und Ponys und ab 2029 auch für die Anwendung bei Hunden, Katzen und Pelztieren (Füchse und Nerze) unter die Meldepflicht.
28. Überblick betreffend die Neuerungen bei der Datensammlung und Meldung durch die Tierärzt:innen.
29. Ich bin Tierärzt:in und möchte meine Meldung (Abgabemeldung bzw. Abgabemeldung und Anwendungsmeldung) über eine anerkannte Meldestelle abgeben.
Änderung auf Basis der Novelle der nationalen Veterinär-Antibiotika-MengenströmeVO zu erwarten!
Bitte setzen Sie sich mit einer der anerkannten Meldestellen in Verbindung.
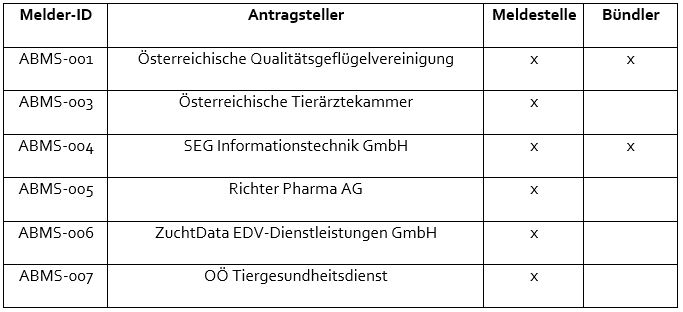
30. Ich bin Tierärzt:in und will beim freiwilligen System mitmachen. Wie kann ich das machen?
Die freiwilligen Detailmeldungen (der Anwendung) werden über sogenannte Bündler oder selbstständig vorgenommen.

31. Ich bin Tierärzt:in und an meinem Berufssitz sind mehrere Tierärzt:innen tätig. Kann die Bestellung von Arzneimitteln mit antimikrobiellen Wirkstoffen und deren Abgabemeldung durch eine Person für alle erfolgen?
Grundsätzlich ist es möglich, „Sammelbestellungen“ vorzunehmen. Dabei ist allerdings nach den einzelnen TÄ-HAPOs zu trennen und nach TÄ-HAPO-ID aufzugliedern. Eine Bestellung unter Angabe einer einzigen TÄ-HAPO-ID für alle am gleichen Standort befindlichen TÄ-HAPO ist hingegen nicht zulässig. Desgleichen muss auch die Jahresmeldung der Abgabe und Anwendung für jede TÄ-HAPO am gleichen Standort getrennt vorgenommen werden, die Meldungen sind auch einzeln abzugeben.
32. Ich bin Tierärzt:in und habe meine tierärztliche Hausapotheke beendet. Welche Pflichten treffen mich dann?
Wenn Sie unterjährig ihre Tätigkeit beenden, so ist dennoch die Abgabemeldung, Anwendungsmeldung oder Leermeldung für das betroffene Jahr erforderlich. D.h. wenn sie zum Beispiel mit Ende Mai 2024 ihre Tätigkeit als HAPO-führende/r Tierärzt:in beenden, hat von Ihnen für den Zeitraum Jänner bis Mai 2024 eine Meldung zu erfolgen. Auch nach Abmeldung der tierärztlichen Hausapotheke, ist die Meldung im darauffolgenden Berichtsjahr technisch möglich.
33. Ich möchte anerkannte Meldestelle werden. Was muss ich tun? Welche Pflichten treffen mich dann?
Anerkannte Meldestellen übernehmen die Datenübermittlung für die Jahresmeldungen der Tierärzt:innen betreffend die Abgabe bzw. Abgabe und Anwendung von Arzneimitteln mit antimikrobiellen Wirkstoffen (Abgabemeldung bzw. Abgabemeldung und Anwendungsmeldung). Sie müssen die eingehenden Meldungen plausibilisieren und über funktionierende Schnittstellen verfügen, über die die Daten an die AGES übermittelt werden.
Zur Überprüfung des Vorliegens der technischen Voraussetzungen ist ein Testlauf zu absolvieren. Zu Fragen über dessen Ablauf kontaktieren Sie bitte die AGES (E-Mail: basg-eservices@ages.at) - diese wird ein Schreiben an das Bundesministerium für Soziales, Gesundheit, Pflege und Konsumentenschutz (BMSGPK) richten und bestätigen, dass Sie die technischen Voraussetzungen zum Betrieb einer anerkannten Meldestelle im Sinne des § 7 Abs. 4f Vet-AB-MengenströmeVO erfüllen. Das BMSGPK wird eine diesbezügliche Mitteilung in den „Amtlichen Veterinärnachrichten“ (AVN) veröffentlichen. Erst mit dieser Veröffentlichung in den AVN dürfen Sie Ihre Tätigkeit als anerkannte Meldestelle aufnehmen.
Es wird darauf hingewiesen, dass anerkannte Meldestellen die Verarbeitung personenbezogener Daten unter strenger Beachtung des Datenschutzes vornehmen müssen.
34. Ich möchte Bündler werden. Was muss ich tun? Welche Pflichten treffen mich dann?
Änderung auf Basis der Novelle der nationalen Veterinär-Antibiotika-MengenströmeVO zu erwarten!
Bündler übernehmen die Datenübermittlung für die freiwilligen Detailmeldungen von Tierärzt:innen oder Tierhalter:innen betreffend die Anwendung von Arzneimitteln mit antimikrobiellen Wirkstoffen (freiwillige Detailmeldung). Sie müssen die eingehenden Meldungen plausibilisieren, anonymisieren und über funktionierende Schnittstellen verfügen, über die die Daten an die AGES übermittelt werden. Gleichzeitig müssen Bündler in der Lage sein, auch die Pflichtmeldungen (Abgabemeldung bzw. Abgabemeldung und Anwendungsmeldung) der Tierärzt:innen für die betreffende Tierart an die AGES zu übermitteln.
Zur Überprüfung des Vorliegens er technischen Voraussetzungen ist ein Testlauf zu absolvieren. Zu Fragen über dessen Ablauf kontaktieren Sie bitte die AGES (E-Mail: basg-eservices@ages.at) - diese wird ein Schreiben an das Bundesministerium für Soziales, Gesundheit, Pflege und Konsumentenschutz (BMSGPK) richten und bestätigen, dass Sie die technischen Voraussetzungen zum Betrieb eines Bündlers im Sinne des § 9 Vet-AB-MengenströmeVO erfüllen. Das BMSGPK wird eine diesbezügliche Mitteilung in den „Amtlichen Veterinärnachrichten“ (AVN) veröffentlichen. Erst mit dieser Veröffentlichung in den AVN dürfen Sie Ihre Tätigkeit als Bündler aufnehmen.
35. Kann ich Bündler werden, ohne gleichzeitig anerkannte Meldestelle zu sein?
Nein. Die Festlegung, dass Sie als Bündler tätig werden dürfen, setzt voraus, dass Sie für jene Tierart, für die Sie als Bündler agieren, auch die Pflichtmeldungen von Arzneimitteln mit antimikrobiellen Wirkstoffen (Abgabemeldung bzw. Abgabemeldung und Anwendungsmeldung) der von Ihnen betreuten Tierärzt:innen übernehmen, in dieser Hinsicht also auch als anerkannte Meldestelle tätig werden.
36. Kann ich die Eigenschaft einer anerkannten Meldestelle bzw. eines Bündlers wieder verlieren?
Ja. Wenn die technischen Voraussetzungen nicht mehr gegeben sind, erlischt Ihre Anerkennung als Meldestelle bzw. als Bündler. Diese Tatsache wird vom BMSGPK in den AVN veröffentlicht.
Fragen zur Datenbereitstellung und Durchführung der Meldungen
37. Wie müssen Retouren bei der Verkaufsmeldung berücksichtigt werden?
Es müssen die aggregierten Jahressummen gemeldet werden. Darin sind Retouren natürlich auch enthalten. Beispiel: Die tierärztliche Hausapotheke 1 kauft 200 Packungen vom Produkt A und retourniert 50 Packungen davon im Jahr 2014. Daraus ergibt sich eine Jahressumme von 150 Packungen vom Produkt A für die tierärztliche Hausapotheke 1.
38. Wie müssen jahresübergreifende Retouren bei der Verkaufsmeldung gemeldet werden, z.B. Verkauf am 30.12.2014 und davon Retouren in 2015?
Diese Retouren müssen dann in der Meldung für das Jahr 2015 berücksichtigt werden.
Beispiel: Die tierärztliche Hausapotheke 1 kauft im Jahr 2014 vom Produkt A 200 Packungen. Daraus ergibt sich eine Jahressumme von 200 Packungen vom Produkt A für das Jahr 2014 für die tierärztliche Hausapotheke 1. Im Jahr 2015 werden davon am 7. Jänner 50 Packungen retourniert und im Laufe des Jahres 150 Packungen gekauft. Das ergibt eine Jahressumme von 100 Packungen vom Produkt A für 2015 für die tierärztliche Hausapotheke 1.
39. Wie können jahresübergreifende Rückgaben gemeldet werden?
Die Meldefrist endet am 31.3. jeden Jahres; bei Rückgaben zwischen dem 1.1. und 31.3. (von im Meldejahr abgegeben relevanten ASPs) können diese direkt in der Abgabemeldung berücksichtigt bzw. "herausgerechnet" werden. Falls die Abgabedaten bereits gemeldet wurden, so kann eine neue vollständige Meldung mit den korrigierten Daten durchgeführt werden.
40. Muss auch bei einer UMWIDMUNG, also für die im Rahmen eines Therapienotstandes umgewidmeten Arzneimittel mit antimikrobiellen Wirkstoffen eine „Meldung der Abgabe bzw. Anwendung“ gemacht werden?
Eine Abgabemeldung bzw. Abgabemeldung und Anwendungsmeldung von Tierarzneimitteln mit antimikrobiellen Wirkstoffen zur Anwendung bei lebensmittelliefernden Tieren ist auch erforderlich, sofern Produkte mit antimikrobiellen Wirkstoffen, die zwar in Österreich zugelassen, primär jedoch nicht für die behandelte Tierart bzw. für die betreffende Indikation zugelassen sind, die aber aufgrund eines Therapienotstandes, sprich im Rahmen einer Umwidmung gem. den Artikeln 112 - 114 der EU VO 2019/6 (vormals § 4 Abs. 2 Ziffer 1 des Tierarzneimittelkontrollgesetzes (TAKG) für die Anwendung bei der betreffenden Tierart abgegeben bzw. direkt angewendet werden.
Diese Regelung gilt für alle Nutztierarten, bei denen eine Abgabe zur Anwendung von umgewidmeten Tierarzneimittel mit antimikrobiellen Wirkstoffen erfolgt.
Keine Meldung ist (bis 2023) derzeit erforderlich, wenn im Rahmen einer Umwidmung Tierarzneimittel mit antimikrobiellen Wirkstoffen zur Anwendung an lebensmittelliefernden Tieren aus einem anderen Mitgliedsstaat der EU verbracht („Sonderimport“) werden.
NEU: Die Meldung von im Rahmen einer Umwidmung gem. den Artikeln 112 - 114 der EU VO 2019/6 (vormals § 4 Abs. 2 Ziffer 2b) des TAKG) aus einem anderen Mitgliedsstaat der EU verbrachter Arzneimittel mit antimikrobiellen Wirkstoffen zur Anwendung an Tieren ist ab den folgenden Jahren nach Tierarten gestaffelt verpflichtend:
- Datenerfassung ab 2023 und Meldung ab 2024 für lebensmittelliefernde Tiere
- Datenerfassung ab 2026 und Meldung ab 2027 für Pferde (inkl. Ponys)
- Datenerfassung ab 2029 und Meldung ab 2030 für Hunde und Katzen
NEU: Arzneimittel mit antimikrobiellen Wirkstoffen, die in Österreich zur Anwendung am Menschen zugelassen sind und im Rahmen der Umwidmung angewendet werden dürfen (siehe ATC-Codes in o.g. Verordnung), müssen wie auch die verbrachten Arzneimittel nach Tierarten gestaffelt ab den folgenden Jahren verpflichtend gemeldet werden:
- Datenerfassung ab 2023 und Meldung ab 2024 für lebensmittelliefernde Tiere
- Datenerfassung ab 2026 und Meldung ab 2027 für Pferde (inkl. Ponys)
- Datenerfassung ab 2029 und Meldung ab 2030 für Hunde und Katzen
41. Ist eine Abgabe-Meldung für Sonderimporte (ohne österreichische/EU-Zulassungsnummer) erforderlich?
Sonderimporte werden über die AWE Meldung durch die berechtigen Stellen gemäß §4 Abs.1 AWEG (z.B. Großhändler, öffentliche Apotheken) gemeldet. Diese Meldungen werden jährlich durch die AGES ausgewertet und fließen in die Mengenstrom-Berichte ein. In den Tierarzt-spezifischen Auswertungen scheinen diese Arzneimitel nicht auf.
42. Wie muss die Packungsgröße bzw. Packungseinheit bei der Verkaufsmeldung gemeldet werden?
Änderung auf Basis der Novelle der nationalen Veterinär-Antibiotika-MengenströmeVO zu erwarten!
Im Stammdatendownload werden die unterschiedlichen Packungsgrößen (numerischer Wert) und Packungseinheiten (Katalog) bereitgestellt. In dieser Form muss die Meldung erfolgen, da vom System auf eine gültige Packungsgröße/-einheit geprüft wird.
43. Welche Menge soll gemeldet werden, falls nur "halbe" Packungen abgegeben bzw. angewendet werden?
Die Abgabemenge bezieht sich grundsätzlich auf die veröffentlichte Anwendungseinheit sowie auf die Einheit der Packungsgröße (z.B. "Stück", "ml", "g" etc.) der Arzneispezialität.
Bei Mengenangaben in "ml" oder "g" ist die Meldung einer Teilmenge möglich. D.h. falls aus einer Packungsgröße mit 200 ml nur 100 ml abgegeben bzw. angewendet werden, sind auch nur 100 ml zu melden.
Bei Mengenangaben in "Stück" wie z.B. bei Euterinjektoren oder Tabletten ist die Meldung einer Teilmenge nur möglich, wenn aus einer Packung mit mehreren Stück ein Teil (z.B. 10 Stück aus einer Packung mit 20 Stück) entnommen wird. Die Teilung einzelner Tabletten oder Euterinjektoren ist nicht vorgesehen.
44. Was bedeutet ADD?
Bei der Animal Daily Dose (ADD) handelt es sich um eine rechnerische Größe, die v.a. für die statistische Auswertung der Daten von Relevanz ist und nicht für den/die Tierärzt:in vor Ort. Die ADD ist der Mittelwert aus den Dosierungsangaben für eine Indikation, Wirksubstanz, Zieltierart und Anwendungsart. ADD ist in diesen Daten in mg/GVE (Milligramm pro Großvieheinheit) angegeben und nicht pro Kilogramm Körpermasse. Eine GVE entspricht 500 kg. Im Humanbereich heißt diese Größe "Defined Daily Dose".
45. Was bedeutet PDD?
Die PDD, Prescribed Daily Dose, bietet für den/die Tierärzt:in eine nützliche Information, da sie sich auf das jeweilige Produkt bezieht, das der/die Tierärzt:in gerade anwenden möchte - sie ist also "produktbezogen" und bezieht sich wie die Dosierung in der Fachinformation auf ein kg Lebendmasse, sie wird in mg/kg KGW (Körpergewicht) angegeben und beträgt 80% der maximalen Dosierung.
46. Was bedeutet DDDvet und DCDvet?
Die DDDvet, Defined Daily Dose for animals, und die DCDvet, Defined Course Dose for animals, wurden basierend auf den Informationen zu Dosierungen aus den Fachinformationen antimikrobieller Tierarzneimittel von neun EU-Mitgliedsstaaten eigens für das ESVAC (European Surveillance of Veterinary Antimicrobial Consumption) Projekt entwickelt/festgelegt. Das Hauptziel des DDDvet- und DCDvet-Systems ist die Bereitstellung standardisierter Maßeinheiten für die Meldung von Daten über den Verbrauch antimikrobieller Tierarzneimittel nach Tierarten. Unterschiede in der Dosierung zwischen den einzelnen Tierarten und Substanzen werden dabei berücksichtigt. Diese Umrechnungswerte dienen zur Auswertung und Vergleich von Daten.
47. Was bedeutet Erhaltungsdosis?
Unter Erhaltungsdosis versteht man die Menge eines Arzneimittels/Wirkstoffes (= Dosis), die verabreicht werden muss, damit die erwünschte Wirkung eintritt. Das Arzneimittel/der Wirkstoff muss dabei nicht zwingend im "Dauertropf" (intravenöse Anwendung) verabreicht werden - jede für ein Arzneimittel zugelassene Anwendungsart (zum Eingeben über Wasser oder Futter, Anwendung auf der Haut, subkutane Anwendung, intramuskuläre Anwendung etc.) muss die für den Therapieerfolg notwendige Konzentration an Wirkstoff am Wirkungsort hervorbringen können.
48. Als Unternehmen vertreibe ich Tierarzneimittel mit antimikrobiellen Wirkstoffen an TÄ-HAPOs und/oder andere Apotheken. Welche Möglichkeiten habe ich, die Vertriebsmeldung abzugeben?
Es besteht seit 2015 ausschließlich die Möglichkeit der elektronischen Meldung über das Portal der AGES. Ein mit den entsprechenden Daten befülltes xml-File (siehe Schema Meldung_Vertrieb.xsd) ist am Portal hochzuladen. Nähere Informationen zur Registrierung auf unserem Portal finden Sie hier: Veterinär Antibiotika Mengenstromanalyse.
49. Als Tierärzt:in gebe ich Arzneimittel mit antimikrobiellen Wirkstoffen aus meiner TÄ-HAPO ab. Welche Möglichkeiten habe ich, die Jahresmeldung über die Abgabe bzw. Anwendung abzugeben?
Änderung auf Basis der Novelle der nationalen Veterinär-Antibiotika-MengenströmeVO zu erwarten!
Die Jahresmeldung – bis 2023 nur Abgabemeldung - soll auf elektronischem Weg über das Portal der AGES abgegeben werden. Ein mit den entsprechenden Daten befülltes xml.File (siehe Schema Meldung_Abgabe.xsd) ist am Portal hochzuladen. Nähere Informationen zur Registrierung auf unserem Portal finden Sie hier: Veterinär Antibiotika Mengenstromanalyse. Die Jahresmeldung kann aber auch an eine anerkannte Meldestelle übermittelt werden. In welcher Form die Übermittlung der Daten zu erfolgen hat, ist mit der jeweiligen Meldestelle zu klären (eine detaillierte Liste der anerkannten Meldestellen wird in den AVN veröffentlicht).
Die Meldestelle prüft Ihre Meldung auf Plausibilität und Vollständigkeit der Daten und übernimmt die Datenübermittlung an die AGES.
50. Als Unternehmen vertreibe ich Tierarzneimittel mit antimikrobiellen Wirkstoffen an tierärztliche Hausapotheken und/oder andere Apotheken. Muss ich ALLE Produkte, die antimikrobielle Wirkstoffe enthalten, melden?
Änderung auf Basis der Novelle der nationalen Veterinär-Antibiotika-MengenströmeVO zu erwarten!
Die Meldung des Vertriebs ist erforderlich für ALLE Tierarzneimittel, die antimikrobielle Wirkstoffe enthalten und für NUTZTIERE und/oder HEIMTIERE in Österreich zugelassen sind, d.h. es sind auch solche Produkte meldepflichtig, die ausschließlich für Heimtiere (Pets) oder Pferde zugelassen sind. Die zu meldenden Tierarzneimittel mit antimikrobiellen Wirkstoffen sind an ihrem ATCvet-Code (siehe Veröffentlichung in den AVN) erkennbar.
Für die Vertriebsmeldung 2023 ist gemäß AVN der Vertrieb antimikrobieller Tierarzneimittel mit den folgenden ATCvet-Codes zu melden - der ATCvet-Code eines Tierarzneimittels ist im Abschnitt 5. (bzw. 4.1 bei Texten im neuen QRD-Format Version 9.0) der Fachinformation (SPC) angegeben:
NEU: Die ab 2024 zu meldenden ATCvet-Codes sind dem Anhang der Verordnung (EU) 2021/578 zu entnehmen. Dabei wird in dieser Verordnung zwischen ATCvet-Codes von antimikrobiellen Tierarzneimitteln, die verpflichtend zu melden sind und solchen mit einem ATCvet-Code, die auf freiwilliger Basis gemeldet werden können, unterschieden.
51. Als Tierärzt:in gebe ich Arzneimittel mit antimikrobiellen Wirkstoffen aus meiner TÄ-HAPO an Tierbesitzer:innen ab. Muss ich ALLE Arzneimittel, die antimikrobielle Wirkstoffe enthalten, melden? Auch die direkte Anwendung oder Verschreibungen?
Änderung auf Basis der Novelle der nationalen Veterinär-Antibiotika-MengenströmeVO zu erwarten!
Derzeit, d.h. für den Erfassungszeitraum 2022 ist eine Meldung der Abgabe (Abgabemeldung) erforderlich. Dies gilt für Tierarzneimittel, die antibiotische Wirkstoffe enthalten und gem. § 7 (2) ABM-VO für mindestens eine der folgenden lebensmittelliefernden Tierarten in Österreich zugelassen sind:
- Rind, Schaf, Schwein und Ziege sowie
- sonstige Wiederkäuer, Schwielensohler, Vögel, Hausgeflügel, Kaninchen oder Tiere der Aquakultur, sofern sie zur Gewinnung von Lebensmitteln oder von anderen zur Anwendung am oder im Menschen dienenden Produkten vorgesehen sind.
Zusätzlich ist der jeweiligen ATCvet-Code des Tierarzneimittels Basis für die Meldepflicht - die betroffenen ATCvet-Codes sind in den „Amtlichen Veterinärnachrichten“ (AVN) veröffentlicht.
Derzeit sind gemäß AVN antimikrobielle Tierarzneimittel mit den folgenden ATCvet-Codes zu melden - der ATCvet-Code eines Tierarzneimittels ist im Abschnitt 5. (bzw. 4.1 bei Texten im neuen QRD-Format Version 9.0) der Fachinformation (SPC) angegeben:
Das Anatomical Therapeutic Chemical classification system for veterinary medicinal products (Anatomisch-therapeutisch-chemische Klassifikationssystem) ist ein von der Weltgesundheitsorganisation offiziell herausgegebenes international gültiges Klassifikationssystem für Arzneistoffe, die in der Veterinärmedizin verwendet werden. Mit Hilfe des ATCvet-Codes lassen sich Tierarzneimittel in therapeutische Kategorien einteilen. Damit wird das Auffinden von Tierarzneimitteln für bestimmte Indikationen und Anwendungsarten wesentlich erleichtert (siehe https://www.whocc.no/atcvet/).
Der ATCvet-Code besteht i.d.R. aus einer Kombination von insgesamt 8 Buchstaben und Ziffern. Bei der Meldung müssen die gemäß „Amtlichen Veterinärnachrichten “ angeführten Buchstaben-Zahlenkombination (siehe oben), sprich die ersten 4 bzw. 6 Stellen des ATCvet-Codes mit dem in der Fachinformation unter Punkt 5. bzw. 4.1 angegebenen ATCvet-Code übereinstimmen. Die letzten 2 bzw. 4 Stellen können unbeachtet bleiben, sie bezeichnen nur Wirkstoffklassen bzw. die Untergruppe eines Wirkstoffes.
Beispiel für die Struktur des ATCvet Codes anhand der vollständigen Klassifizierung von Ampicillin für die systemische Anwendung : ATCvet-Code QJ01CA01
QJ - Antiinfektiva zur systemischen Anwendung (1. Ebene, anatomische Hauptgruppe)
01 - Antibiotika/Chemotherapeutika zur systemischen Anwendung (2. Ebene, therapeutische Hauptgruppe)
C - Betalactam-Antibiotika (Penicilline) zur systemischen Anwendung (3. Ebene, therapeutische Untergruppe)
A - Betalactam-Antibiotika, Breitspektrum-Penicilline zur systemischen Anwendung (4. Ebene, chemisch/therapeutische Untergruppe)
01 - Ampicillin (5. Ebene, Untergruppe für den Wirkstoff)
Das gleiche Klassifikationssystem existiert auch für Wirkstoffe, die in der Humanmedizin verwendet werden. Ein Unterschied ist, dass die ATC-Codes nur 7-stellig sind, sie haben kein „Q“ am Beginn (siehe https://www.whocc.no/atc_ddd_index/).
NEU: Ab 2024 sind nicht nur aus der TÄ-HAPO abgegebene antimikrobielle Tierarzneimittel zu melden, sondern auch solche, die dem/der Tierbesitzer:in per Rezept für seine Tiere verordnet oder direkt vom/von der Tierärzt:in an den Tieren angewendet werden. Zusätzlich sind gegebenenfalls auch zur Behandlung eingesetzte antimikrobielle Humanarzneimittel zu melden. Die ATCvet- bzw. ATC-Codes für die Abgabemeldung und die Anwendungsmeldung sind dem Anhang der VO (EU) 2021/578 zu entnehmen (siehe auch Tabelle unten). Dabei wird in dieser Verordnung zwischen ATCvet-/ATC-Codes von antimikrobiellen Arzneimitteln, die verpflichtend zu melden sind und solchen mit einem ATCvet-/ATC-Code, die auf freiwilliger Basis gemeldet werden können, unterschieden:
52. Als Unternehmen habe ich eine Fehlermeldung bei der Erstattung der Jahresmeldung erhalten? Worauf muss ich bei der „Meldung Vertrieb“ achten? Woher bekomme ich die benötigten Daten für eine korrekte Meldung?
Die korrekten Daten zur Befüllung der Felder „Zulassungsnummer“, „Packungsgröße“ und „Einheit der Packungsgröße“ entnehmen Sie am besten dem Arzneimittel-Datensatz der jeweiligen Arzneispezialität aus dem Download (AntibiotikaMengenstromanalyseASP.xml). Bei der Auswahl der Packungsgröße ist, sofern neben einzelnen Packungsgrößen auch Bündelpackungen zugelassen sind, immer die Gesamtmenge anzugeben, also z.B. für eine orale Lösung od. Injektionslösung, wo Packungen zu 10 x 100 ml, 4 x 250 ml, 2 x 500 ml oder 1 x 1000 ml zugelassen sind, ist in jedem Fall die Packungsgröße mit 1000 ml anzugeben.
53. Als Tierärzt:in bzw. als anerkannte Meldestelle habe ich eine Fehlermeldung bei der Erstattung der Jahresmeldung über das Portal der AGES erhalten? Worauf muss ich bei der Abgabemeldung bzw. Anwendungsmeldung achten? Wo finde ich die korrekten Daten?
Änderung auf Basis der Novelle der nationalen Veterinär-Antibiotika-MengenströmeVO zu erwarten!
Die „MelderID“ ist für den Fall, dass Sie als Tierärzt:in die Meldung direkt über das Portal des BASG abgeben, die selbe wie die „HAPO-ID“. Diese erhalten Sie nach Meldung ihrer tierärztlichen Hausapotheke bei der Bezirksverwaltungsbehörde bzw. am Magistratischen Bezirksamt von der Tierärztekammer.
Die MelderID für anerkannte Meldestellen wird nach der Meldung als solche von der durchführenden Stelle vergeben. Das Meldeformular hierzu ist seit 1. 12. 2015 auf der BASG-Webseite zum Download bereitgestellt.
Das Feld „LFBIS“ (Landwirtschaftliche Betriebsnummer) ist auch zu befüllen, wenn Tierarzneimittel mit antibiotischen Wirkstoffen zur Behandlung von lebensmittelliefernden Tieren abgegeben werden, die nicht zu einem landwirtschaftlichen Betrieb gehören. Anstelle der LFBIS ist hier ist die VIS-Nummer anzugeben.
Die korrekten Daten zur Befüllung der Felder „Zulassungsnummer“ und „Anwendungseinheit“ sind dem Download des Arzneimittel-Datensatzes der jeweiligen Arzneispezialität zu entnehmen. Die „Tierart“ sowie die „Nutzungsart“ zur betreffenden Zieltierart sind aus den auf der BASG-Webseite veröffentlichten Katalogen „Tierart für Meldungen“ (Katalog_Tierart für Meldungen) bzw. „Nutzungsart“ (Katalog_Nutzungsart) passend auszuwählen (Link).
Als Nutzungsart bei Schweinen, Rindern, kleinen Wiederkäuern und Geflügel ist die passende Nutzungsart entsprechend ihrer Verwendung auszuwählen, bei Farmwild, Lamas, Straußen und Fischen ist je nach Nutzungsart „zur Lebensmittelproduktion“ oder „nicht zur Lebensmittelproduktion“ auszuwählen.
54. Warum gibt es nicht bei allen Arzneimitteln im Arzneimittel-Datensatz (Stammdaten-Download) bzw. im Arzneispezialitätenregister einen Link zur jeweiligen Fach- und Gebrauchsinformation?
Produktinformationen zentral (in der gesamten EU gleichzeitig) zugelassener Arzneimittel, erkennbar an einer Zulassungsnummer, die mit EU/2/... oder EU/1/… beginnt, finden Sie im Community Register der Europäischen Kommission. Für die Veröffentlichung der jeweils aktuellsten Version der Produktinformationen ist hier die Kommission zuständig. Ein direkter Link auf Texte zentral zugelassener Arzneimittel kann nicht angeboten werden, da sich die Internetadressen dieser Seiten laufend ändern können.
55. Ich bin Landwirt:in und sorge mich um die Anonymität meiner Daten. Wie wird die Anonymisierung der in die Datenbank eingehenden Daten gewährleistet?
Sollten die Ihren Betrieb betreffenden Daten über einen Bündler (mit welchem Sie bereits davor eine Datenschutzvereinbarung geschlossen haben werden) an die auswertende Stelle (AGES) versendet werden, so trägt dieser die Sorge dafür, dass Ihre Daten bei Versendung aus dem Datenverarbeitungssystem des Bündlers anonymisiert werden: Ihre LFBIS-Nummer wird verschlüsselt an die Datenbank der AGES versendet, Rückschlüsse auf Ihren Betrieb sind dadurch nicht möglich.
Technische Fragen
56. Welche Dateiformate werden für Meldungen unterstützt?
Änderung auf Basis der Novelle der nationalen Veterinär-Antibiotika-MengenströmeVO zu erwarten!
Bitte beachten Sie, dass Meldungen ausschließlich im XML-Format möglich sind.
Schemabeschreibungen zur Datenbereitstellung finden Sie hier.
57. Welche Zeichen dürfen in den Meldungs-XMLs nicht verwendet werden?
Folgende Zeichen können nicht verwendet werden, da ihnen in XML-Dateien eine besondere Bedeutung zukommt und müssen wie folgt ersetzt werden:
" --> "
' --> '
& --> &
Rückfragehinweis:
Fachliche Fragen zu Arzneispezialitäten: basg-heve@basg.gv.at
Fachlichen Fragen zur Meldung und Auswertung: ab-mengenstrom@ages.at
Technische Fragen: basg-eservices@basg.gv.at
