Sicherheitsmerkmale
Umsetzung der Arzneimittelfälschungsrichtlinie – digitales Arzneimittel Sicherheitssystem gewährleistet mehr Sicherheit für österreichische Patient:innen
Die Hintergründe der Serialisierung in Österreich und Europa
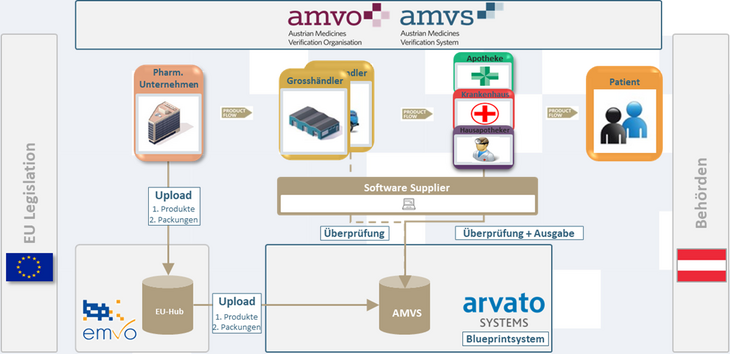
Im Rahmen der EU-Richtlinie 2011/62/EU zur Vermeidung von Fälschungen in der legalen Lieferkette und ihrer Delegierten Verordnung (EU) 2016/161 ist in allen Mitgliedstaaten ein Datenspeicher- und Datenabrufsystem einzurichten, um die Verifizierung von Arzneimitteln bei der Abgabe an die Patient:innen ab 9. Februar 2019 zu ermöglichen. Dieses Datenspeicher- und Datenabrufsystem ist nach den rechtlichen Rahmenbedingungen von der pharmazeutischen Industrie unter Einbindung der Stakeholder der Lieferkette einzurichten und zu betreiben.
Von den Stakeholdern Pharmig – Verband der pharmazeutischen Industrie Österreichs, Österreichischer Generikaverband OeGV, PHAGO (Verband der Österreichischen Arzneimittelvollgroßhändler) und Österreichische Apothekerkammer wurde im Jahr 2016 gemeinsam die AMVO – Österreichischer Verband für die Umsetzung der Verifizierung von Arzneimitteln (kurz „AMVO“) gegründet, der die Österreichische Ärztekammer im Jahr 2017 beigetreten ist. Der Aufsichts- und Kontrollbeirat der AMVO wird von den Mitgliedsorganisationen unter Einbindung des Gesundheitsministeriums und des Bundesamtes für Sicherheit im Gesundheitswesen (BASG) besetzt. Der Aufsichts- und Kontrollbeirat der AMVO nimmt die Aufsichts- und Kontrollbefugnisse über die Einhaltung der anzuwendenden rechtlichen Rahmenbedingungen für die Betreibergesellschaft wahr. Für die Errichtung und den Betrieb des österreichischen Datenspeicher- und Datenabrufsystems (kurz: „AMVS“), die Verbindung zum Europäischen Datenspeicher- und Datenabrufsystem sowie die Zurverfügungstellung von Schnittstellen zu den Arzneimittelgroßhändlern (kurz: „Großhändler“) und den zur Abgabe von Arzneimitteln an die Öffentlichkeit ermächtigten oder befugten Personen (kurz: „abgabeberechtigte Personen“) wurde Anfang 2017 die AMVS GmbH – Austrian Medicines Verification System GmbH (kurz: „AMVS GmbH“), eine 100%ige Tochter der AMVO, gegründet.
Die Umsetzung der Serialisierung
Für die Umsetzung und Einhaltung der gesetzlichen Bestimmungen kommt den abgabeberechtigten Personen neben den anderen Stakeholdern (Hersteller und Großhändler) eine bedeutende Rolle in der pharmazeutischen Lieferkette zu. Jede mit Sicherheitsmerkmalen versehene Packung eines Arzneimittels muss vor der Abgabe an die Patient:innen überprüft werden. Dabei überprüft die abgabeberechtigte Person den Manipulationsschutz auf der Arzneimittelpackung und scannt den DataMatrix-Code, wodurch die darin enthaltene Seriennummer mit den im nationalen Datenspeicher hinterlegten Seriennummern abgeglichen wird. Diese Verpflichtung besteht für rezeptpflichtige Humanarzneimittel [ausgenommen der in Anhang I der Delegierten Verordnung („Whitelist“) angeführten Arzneimittel].
Um den rechtlichen Verpflichtungen der Richtlinie und der Delegierten Verordnung nachzukommen wurden in den Jahren 2017/18 bei öffentlichen Apotheken, ärztlichen Hausapotheken, Krankenanstalten und den Arzneimittelgroßhändlern die technischen Voraussetzungen geschaffen, um deren Systeme mit dem nationalen Datenspeicher AMVS zu verbinden.
Die AMVS stellte detaillierte Unterlagen zur Verfügung und informierte bei zahlreichen Veranstaltungen vor Ort über die Notwendigkeit und Möglichkeiten zur Anbindung.
Die vorgesehenen Prozesse zum Beitritt in das AMVS wurden mit allen Betroffenen zeitgerecht vollzogen. Anträge, Nutzungsverträge und Zugangsdaten waren unter anderem notwendig, um alle abgebenden Stellen zu aktivieren und so weiterhin die Berechtigung zur Abgabe von verschreibungspflichtigen Arzneimitteln sicherzustellen.
Vollbetrieb ab 9. Februar 2019 – mit Stabilisierungsphase bis 9. Februar 2020
Um einen reibungslosen Start und einen weiterhin hohen Versorgungsgrad zu gewährleisten, startete mit dem 9. Februar 2019 eine Stabilisierungsphase. Bis zum 9. Februar 2020 hatten alle beteiligten Personen und Organisationen die Möglichkeit allfällige Prozess- und Anwendungsfehler zu erkennen und zu beheben.
Für die verifizierenden und abgebenden Stellen (VAS) gilt während der Stabilisierungsphase: Wenn beim Scanvorgang die Meldung „Stabilisierungsphase -Systemüberprüfung- VAS prüft Arzneimittelpackung“ erscheint, muss wie bisher eine Überprüfung auf Echtheit und Unversehrtheit von den Apotheker:innen oder den hausapothekenführenden Ärzt:innen durchgeführt werden. Ist die Arzneimittelpackung augenscheinlich in Ordnung, entscheiden die Apotheker:innen oder die hausapothekenführenden Ärzt:innen wie bisher über die Abgabe und der Geschäftsfall kann abgeschlossen werden.
Während der Stabilisierungsphase bis 9. Februar 2020, wurden alle „Systemüberprüfungsmeldungen“ von der AMVS gemeinsam mit den Zulassungsinhabern analysiert. Aber auch darüber hinaus steht die AMVS, die den nationalen Datenspeicher des digitalen Sicherheitssystems betreibt, als verlässlicher Servicepartner für Fragen rund um die Anbindung an das digitale System zur Verfügung.
Österreich liegt sowohl bei den Anbindungen an das neue digitale System als auch beim laufenden Systembetrieb an vorderster Stelle in Europa. In Österreich befinden sich mit 7. Januar 2025 bereits mehr als 1441 Millionen Arzneimittelpackungen im österreichischen System.
Startphase Echtbetrieb ab 9. Februar 2020
Am 9. Februar 2020 endete die Stabilisierungsphase und begann die “Startphase Echtbetrieb” des AMVS. Während dieser Phase soll allen Stakeholdern ermöglicht werden ihre Prozesse zu optimieren, damit ein problemloser Ablauf des Echtbetriebes gewährleistet werden kann. Mit Stand 17. Juni 2024 lag die Fehlerrate bei Level-5 Alarmen zwischen 0,0-0,1%. Dies ermöglicht den hohen Arzneimittelversorgungsstandard in Österreich weiterhin sicherzustellen.
Es gibt mit 112 Arzneimittel-Großhändlern, 1.431 öffentlichen Apotheken, 25 Krankenanstalten-Trägern sowie 809 hausapothekenführende Ärzt:innen Endbenutzerverträge, die an 2.614 Standorten angebunden sind und damit originale und wirksame Medikamente für Patient:innen sicherstellen (Stand 17. Juni 2024).
Die Überführung der Arzneimittelversorgung in das digitale Zeitalter ist hochkomplex und auch während der Stabilisierungsphase und Startphase Echtbetrieb mit etlichen Umstellungen und Adaptionen bei den Projektpartnern verbunden. Dank der ausgezeichneten Kooperation aller Beteiligten, konnte die AMVS GmbH ihre Projektziele erreichen und ist für verschiedene Szenarien und Herausforderungen rund um den europaweiten Start des neuen Systems in Österreich gut gerüstet und vorbereitet.
Echtbetrieb ab 9. Februar 2026
Mit Stand 12. November 2025 lag die Fehlerrate der Level-5 Alarme zwischen 0,00-0,01%. Der hohe Arzneimittelversorgungsstandard in Österreich ist daher weiterhin sichergestellt.
Deswegen beginnt mit 9. Februar 2026 der Echtbetrieb des digitalen Sicherheitssystems für Arzneimittel in Österreich.
Damit endet die “Startphase Echtbetrieb”. Ab diesem Zeitpunkt gelten die rechtlichen Vorgaben zur Serialisierung und Verifizierung von verschreibungspflichtigen Arzneimitteln vollumfänglich.
Alle verifizierenden und abgebenden Stellen sind verpflichtet, sämtliche Verifizierungs-, Deaktivierungs- und Reaktivierungshandlungen nach den geltenden rechtlichen und vertraglichen Grundlagen vorzunehmen.
Ziel ist ein sicherer, stabiler und rechtskonformer Betrieb des Systems.
Eine Packung darf erst abgegeben werden, wenn ein Alarm geklärt und eine zulässige Korrekturmaßnahme umgesetzt wurde.
Weitere Informationen und Leitlinien finden Sie auf der AMVS Website.
Bei Fragen kann man sich an folgenden Kontakt der AMVS GmbH wenden:
office@amvs-medicines.at
AMVS – Austrian Medicines Verification System GmbH
Square One, Leopold-Ungar-Platz 2, Stiege 1, Top 134, 1190 Wien
Tel.: +43 1 996 94 99 - 0
Letter to stakeholders regarding the implementation of safety features under the Falsified Medicines Directive 2011/62/EU applicable on 9 February 2019
- 17.10.2018
Muss das individuelle Erkennungsmerkmal (unique identifier - UI) immer auf die Verpackung aufgedruckt werden, oder gibt es auch andere Möglichkeiten?
Grundsätzlich JA, der 'unique identifier' muss auf die Packung gedruckt werden. Gemäß QUESTIONS AND ANSWERS 2.21 der Europäischen Kommission zur Umsetzung der Bestimmungen der “Fälschungsrichtlinie“ 2011/62/EU und der Delegierten Verordnung 2016/161/EU kann der UI in bestimmten Ausnahmefällen auch durch Klebeetiketten auf die Packungen aufgebracht werden. In Österreich ist das durch § 3a der Arzneimittelbetriebsordnung 2009 (AMBO 2009) geregelt und Anträge sind mittels nachstehendem Formblatt an das Bundesamt für Sicherheit im Gesundheitswesen zu richten.
Im Falle von bestehenden MRP/DCP und nationalen Zulassungen ist dieser Antrag über CESP, im Falle von Zentralen Zulassungen mit dem Betreff „Antrag § 3a AMBO 2009“ als Mail an cp@basg.gv.at zu übermitteln.
- 12.02.2019