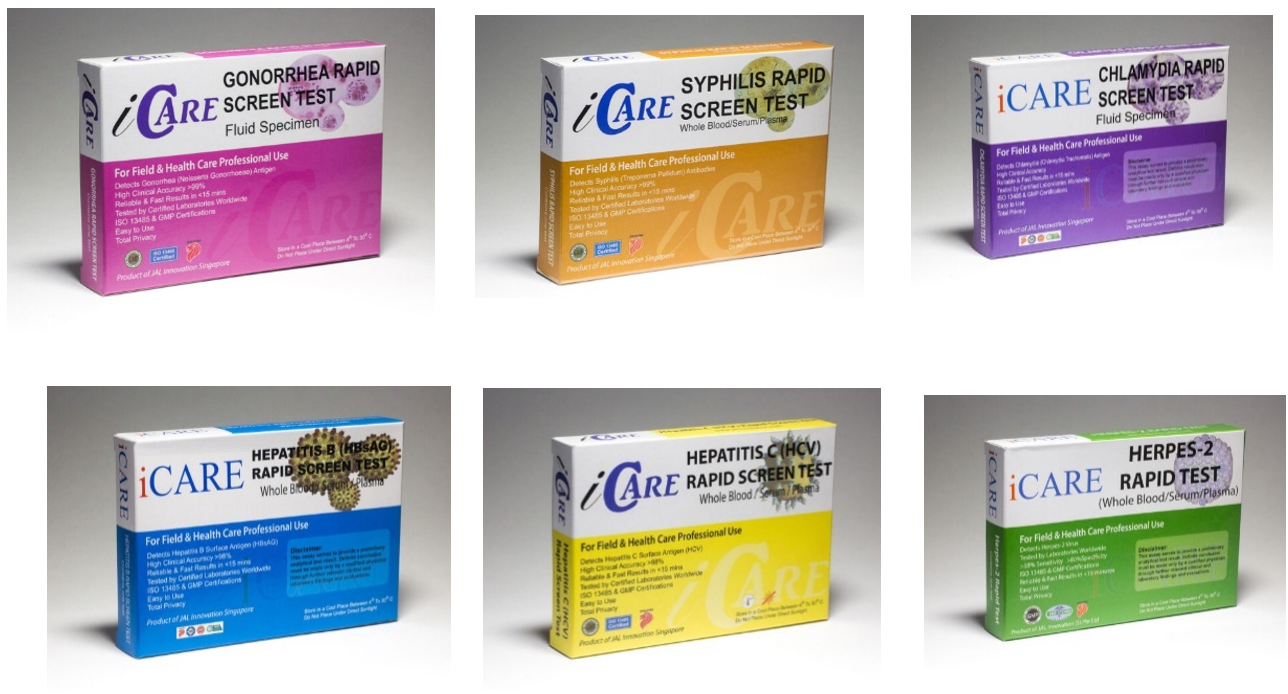
Nicht CE-gekennzeichnete In-vitro-Diagnostika
Das Bundesamt für Sicherheit im Gesundheitswesen (BASG) warnt vor der Anwendung folgender In-vitro-Diagnostika:
- iCare Syphilis Test
- iCare Hepatitis B Test
- iCare Hepatitis C Test
- iCare Chlamydia
- iCare Gonorrhea
- iCare Herpes
Diese Tests zur Eigenanwendung zur Erkennung von sexuell übertragbaren Krankheiten (STDs) des Herstellers Genesign Biotech (XIAMEN) Co., Ltd werden auch unter dem Markennamen JAL Medical (Singapore) Pte. Ltd. vermarktet.
Diese Produkte tragen kein CE-Kennzeichen, womit sie die Anforderungen für In-vitro-Diagnostika nicht erfüllen. Dem BASG liegen Informationen vor, dass der Hersteller das erforderliche EU-Konformitätsbewertungsverfahren nicht durchgeführt hat. Diese Produkte sind somit im Unionsmarkt nicht verkehrsfähig.
Die Sicherheit dieser In-vitro-Diagnostika ist nicht belegt, wodurch ein nicht näher bekanntes Risiko für falsche Ergebnisse besteht.
Derzeit kann nicht ausgeschlossen werden, dass auch noch andere „iCare“ – Tests betroffen sind.
Betroffenen AnwenderInnen dieser Produkte wird empfohlen sich nicht auf das Ergebnis zu verlassen, sondern eine erneute Testung mit einem CE-gekennzeichneten In-vitro-Diagnostikum durchzuführen.
Wenden Sie sich gegebenenfalls an Ihre Ärztin oder Ihren Arzt.
Weitere Informationen, wie Sie konforme In-vitro-Diagnostika sowie Medizinprodukte erkennen können, finden Sie unter Medizinprodukte - BASG
| Hersteller | Genesign Biotech (Xiamen) Co., Ltd. Unit 03, 8th Floor, Building B14, Xiamen Biomedical Industrial Park 2076 Wengjjao West Read, Haicang District, Xiamen 361026, P.R. bzw. JAL Medical (Singapore) Pte. Ltd. |
|---|---|
| Chargennummer(n) | alle |
| Weitere Informationen Link | https://instihivtest.com/de/sicherheitswarnung-icare-jal-medical-selbsttests-nicht-ce-gekennzeichnet/ |